《藥品生產場地管理文件指南》發布!
?
為落實《藥品生產監督管理辦法》(國家市場監督管理總局令第28號)有關藥品生產場地管理的規定,明確場地管理文件的內容、格式及管理要求,根據國家局的布署,核查中心組織起草了《藥品生產場地管理文件指南(試行)》。現向社會公開征求意見。
誠請醫藥界同仁關注并研提意見和建議,請于2020年12月18日前填寫意見和建議反饋表并發送至以下聯系郵箱,感謝支持和配合。??
聯系人:王立杰
郵? 箱: wanglj@cfdi.org.cn?
國家藥品監督管理局食品藥品審核查驗中心
2020年12月3日
藥品生產場地管理文件指南(試行)
第一條??為進一步加強藥品生產場地信息管理,指導藥品生產企業匯總生產場地信息并持續更新,根據《藥品管理法》《疫苗管理法》《藥品生產監督管理辦法》《藥品生產質量管理規范》,制訂本指南。
第二條??境內持有《藥品生產許可證》的藥品生產企業,應當按要求編寫《藥品生產場地管理文件》(Site Master File,SMF),并對藥品生產場地管理文件中信息的真實性和完整性負責。
第三條??藥品生產場地管理文件僅供藥品監督管理部門制定并執行檢查計劃所用。
從事藥品生產活動,必須遵守藥品相關法律、法規;依法應當申報或備案的,藥品生產企業必須履行法定義務,不得通過編寫或更新藥品生產場地管理文件作為替代。
第四條??藥品生產企業有多個生產地址的,每個生產地址均應當建立該地址的獨立藥品生產場地管理文件,描述與該生產場地有關的藥品生產活動基本信息。生產場地中所有藥品生產行為均應當在藥品生產場地管理文件描述。
如某一藥品的生產、包裝、貼簽、檢驗等未在同一場地,則藥品上市許可持有人應當要求每個場地均應建立相應的藥品生產場地管理文件。
第五條???藥品生產企業的藥品生產場地管理文件應當以電子文本和紙質文本兩種方式同時儲存。紙質文件應當為電子文本使用A4紙打印所得。
第六條???藥品生產企業應當將藥品生產場地管理文件(電子文本)提交至生產企業所在地省級藥品監督管理部門,并根據情況及時或定期更新。
第七條??藥品生產場地管理文件屬于藥品生產企業質量管理系統文件的一部分,應當按照《藥品生產質量管理規范》的有關要求進行管理。
藥品生產場地管理文件應當有版本號、生效日期、變更歷史等并經本企業的法定代表人或者企業負責人批準。
第八條??藥品生產企業應當進行定期審核其藥品生產場地管理文件,以保證其為最新版本并代表該場地的最新生產活動。每個附件可有單獨的生效日期和文件修訂歷史,單獨更新。
第九條???藥品生產場地管理文件應當包括正文和附件2個部分。藥品生產場地管理文件不能過于復雜,但必須包含足夠的信息。
編寫藥品生產場地管理文件應當簡明扼要,盡可能采取列表、圖紙等簡要方式進行,必要時可以附件形式對關鍵部分進一步描述。
藥品生產場地管理文件(正文連同附件)原則上不得超過30頁。
第十條???藥品生產場地管理文件至少應當包含生產場地的質量管理方針及在本生產場地進行的藥品生產操作和/或質量控制活動,分為正文、附件2個部分。
藥品生產場地管理文件的格式及具體內容見附件1。
第十一條?????藥品生產場地管理文件必須在該生產場地獲得《藥品生產許可證》后10日內提交至生產企業所在地省級藥品監督管理部門。
第十二條?????《藥品生產許可證》內容變更的,藥品生產企業應當在變更后10日內更新其相關藥品生產場地管理文件并提交至生產企業所在地省級藥品監督管理部門。
第十三條?????根據藥品生產場地各類變更(如藥品生產相關的廠房設施設備變更)的性質、范圍及對產品質量潛在影響的程度,藥品生產企業判斷為主要變更的,如需變更相應藥品生產場地管理文件,應當及時向生產企業所在地省級藥品監督管理部門更新;其他變更所致藥品生產場地管理文件變更,可在每年11月30前向生產企業所在地省級藥品監督管理部門更新。
第十四條?????藥品生產企業的《藥品生產許可證》失效后,該生產企業所涉及的所有藥品生產場地管理文件自動失效。藥品生產企業的某一生產場地在《藥品生產許可證》中去除后,該生產場地的藥品生產場地管理文件自動失效。
附件:藥品生產場地管理文件格式及內容要求
?
1?企業概況
1.1????企業基本信息
1.1.1???????企業名稱、注冊地址
1.1.2???????生產地址、本生產地址的生產范圍
1.1.3???????企業聯系人、本生產場地聯系人及場地質量負責人的聯系方式(應能24小時內隨時可聯系,包括固定電話,手機、電子郵件等)
1.2????藥品生產許可情況
1.2.1 ??????簡要描述生產場地獲得省級藥品監督管理部門批準的藥品生產許可范圍,提供《藥品生產許可證》復印件。
1.2.2 ??????除藥品生產許可范圍內的生產活動,場地內進行的其他生產活動(包括藥品生產許可之外的其他制藥和非制藥活動)。
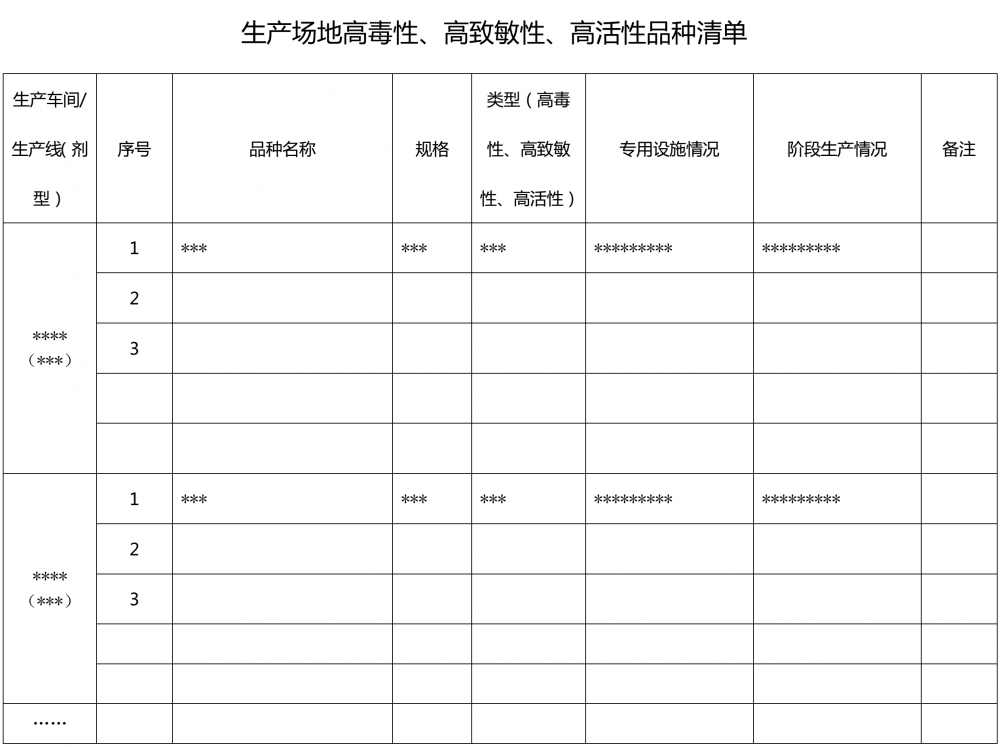
1.2.3 ??????應當以清單目錄形式將本場地所生產的所有品種列明(附件1)。生產場地內是否有處理高毒性、高致敏性、高活性物料的生產操作,如有應當列出(附件2)。
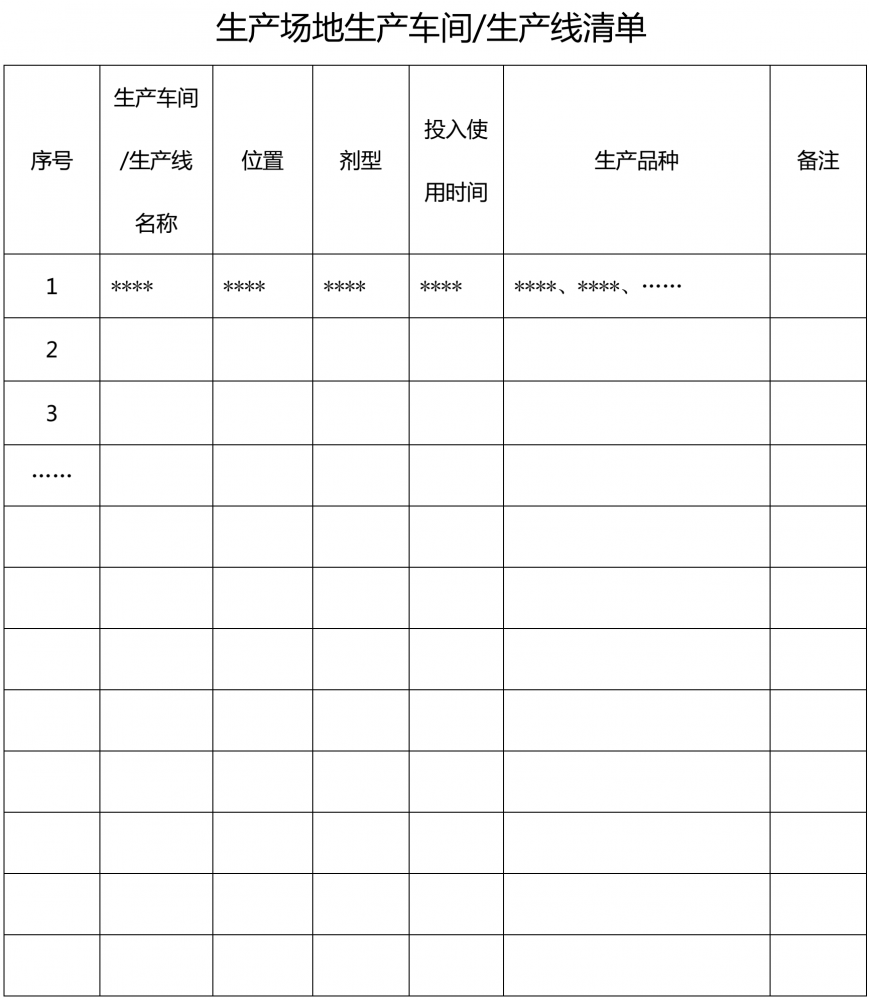
1.2.4 ??????生產場地內生產車間及生產線的設置情況。簡要描述場地的生產車間、每個車間內的生產線。提供生產場地內的生產車間/生產線清單,并標注投入使用時間(附件3)。
1.3????監管檢查情況
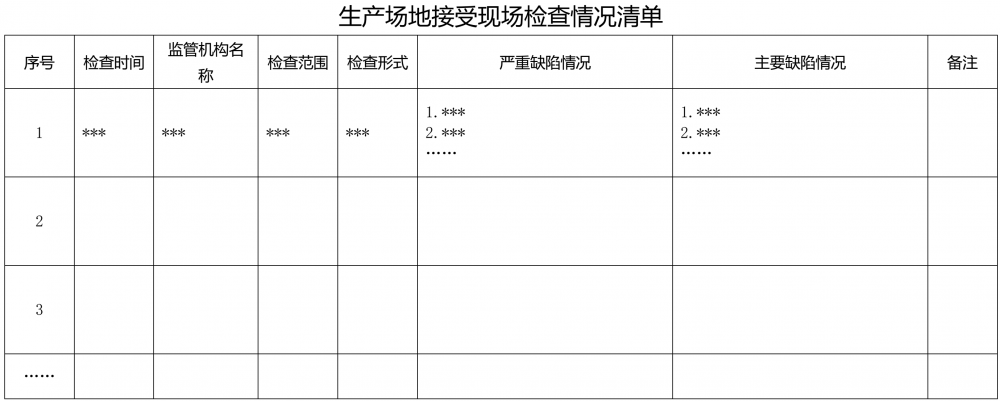
1.3.1 ??????近5年生產場地接受國內省級以上藥品監督管理部門及國外藥品監督管理機構現場檢查情況(包括藥品注冊檢查、GMP符合性檢查、監督檢查等在內的各類檢查),內容包括檢查時間、實施檢查的監管機構名稱、檢查范圍、檢查中發現的嚴重缺陷及主要缺陷(附件4)。
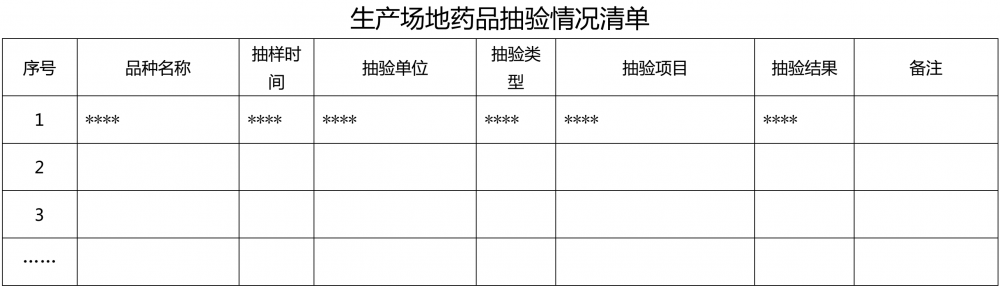
1.3.2 ??????近5年生產場地產品監督抽驗情況,內容包括品種名稱、抽樣時間、抽驗單位、抽驗目的、抽驗項目、抽驗結果等。(附件5)
1.3.3 ??????近5年生產場地受到監督管理部門處罰情況。
2?生產場地質量管理體系
2.1????質量管理體系概述
2.1.1 ??????簡要描述生產場地質量管理體系運行情況以及參考的標準。
2.1.2 ??????質量管理體系的相關管理責任,包括高層管理者、質量管理負責人、質量受權人和質量保證部門的職責。
2.1.3 ??????工廠質量體系獲得政府、組織或第三方機構認證認可等情況,包括認證認可日期、內容、認證認可機構名稱等。
2.2????產品放行程序
2.2.1 ??????負責產品放行人員(質量受權人)的基本信息,包括職務、學歷、職稱、工作經歷等。
2.2.2 ??????概述產品放行程序。
2.2.3 ??????當涉及多名轉受權人時的工作安排。
2.2.4 ??????請說明是否應用過程分析技術(PAT)及實時放行或參數放行產品。
2.3????供應商管理及委托生產、委托檢驗情況
2.3.1 ??????簡述企業供應商管理體系內容。
2.3.2 ??????簡述企業供應商的選擇、質量評估、審計、批準、變更等程序。
2.3.3 ??????簡述委托生產的情況。(如有)
2.3.4 ??????簡述委托倉儲的情況。(如有)
2.3.5 ??????簡述委托檢驗的情況。(如有)
2.3.6 ??????合同生產企業和實驗室名單,包括以下信息:地址、聯系方式、委托生產和質量檢驗活動,例如:無菌工藝產品所用內包裝材料滅菌、原輔料的檢驗等。
2.3.7 ??????簡述委托方和受托方的責任劃分情況。
2.3.8 ??????簡述藥品委托生產協議和質量協議簽訂情況。
2.4????質量風險管理
2.4.1 ??????簡述企業質量風險管理方法。
2.4.2 ??????質量風險管理活動的范圍和重點,以及在質量風險管理體系下進行風險識別、評價、控制、溝通和審核的過程。
3人員
3.1 ???企業及本生產場地質量管理、生產和質量控制的組織機構圖(包括高層管理者),以及質量保證、生產和質量控制部門各自的組織機構圖。
3.2 ???生產場地從事質量保證、生產、質量控制、儲存及發運的員工數量。
4廠房和設備
4.1????廠房
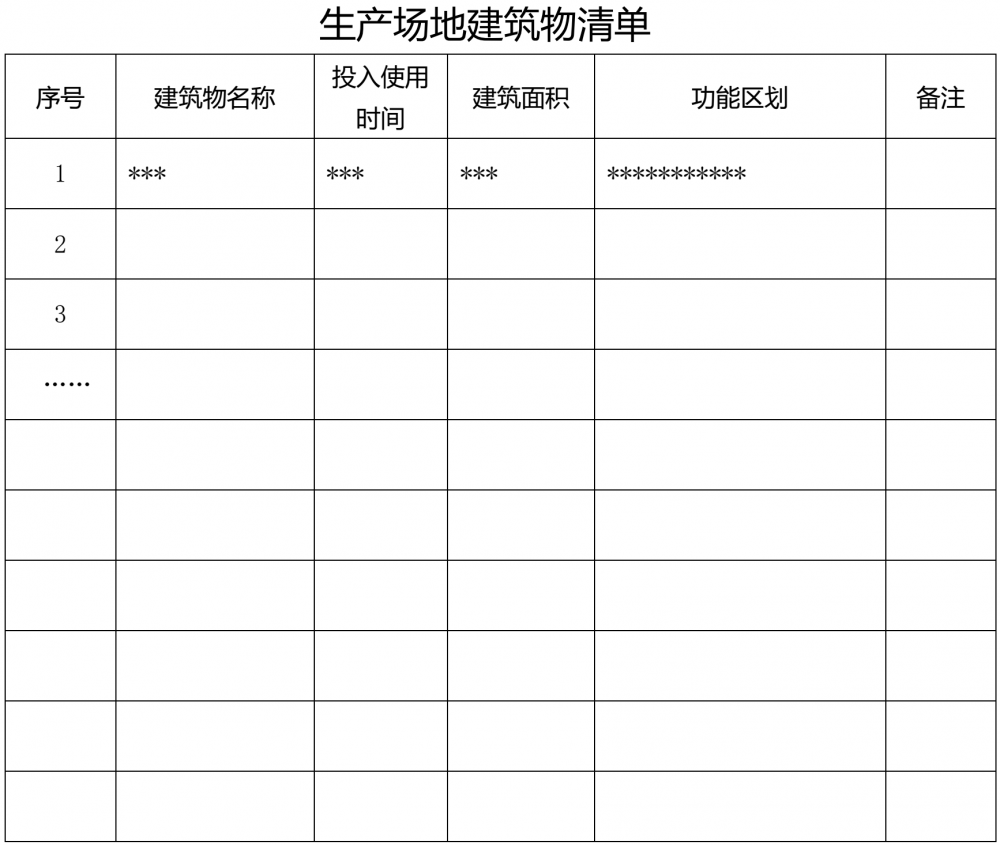
簡述生產場地情況,包括場地面積和建筑物情況。附廠區總平面布局圖及建筑物清單(附件6)。
簡述生產區域規模情況,附生產區域的平面布局圖和流向圖,標明比例(簡圖,無需建筑或工程圖紙)。應當標注出房間的潔凈級別、相鄰房間的壓差,并且能指示房間所進行的生產活動(例如:配料、灌裝、儲存、包裝等)。
簡要描述倉庫、貯存區域以及特殊貯存條件,附倉庫和儲存區域的平面圖,包括儲存和處理高毒性、危險性與特殊儲存條件物料的特殊區域。
生產場地內是否設置有動物實驗室,描述動物實驗室設置位置及布局。(如有)
4.1.1???????空調凈化(HVAC)系統簡述
空調凈化系統的工作原理、設計標準和運行情況,如送風處理流程、控制區域、風量、溫度、濕度、壓差、換氣次數、回風利用率等。如有多個空調凈化系統,還應當明確各空調凈化系統供應生產車間及生產線的情形。
4.1.2???????制藥用水系統簡述
水系統的工作原理、設計標準、運行情況及示意圖。如有多個制藥用水的制備系統或循環系統,還應當明確各系統供應生產線的情形。
4.1.3 ??????簡要描述其他公用設施情況,例如蒸汽、壓縮空氣、氮氣等系統。(如適用)
4.2????設備
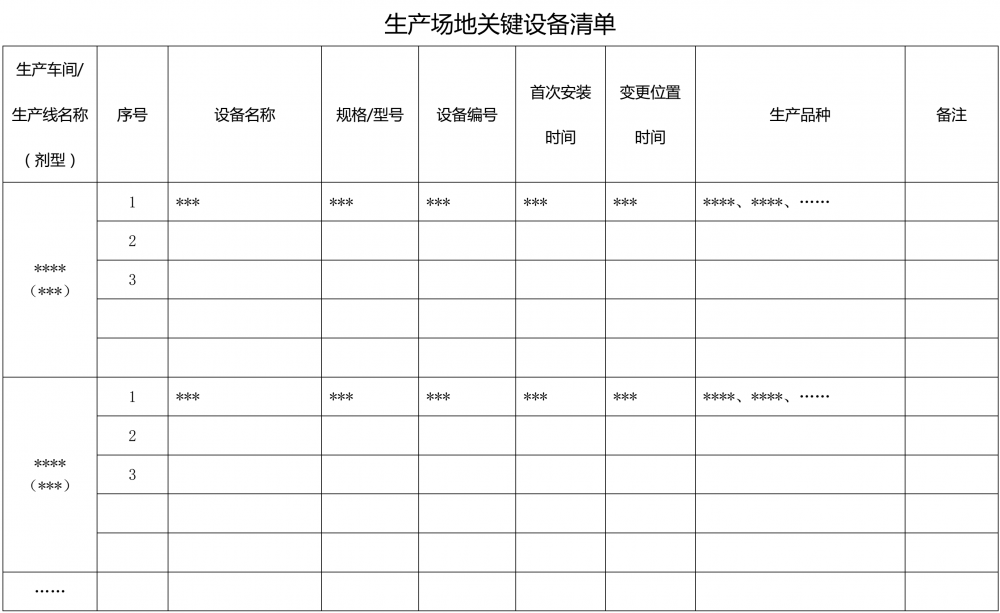
4.2.1 ??????列出生產和檢驗用主要設備儀器清單,關鍵設備應當按車間/生產線填寫,并注明設備首次安裝及變更情況(附件7)。
4.2.2???????清潔與消毒
簡述與藥品直接接觸設備、工器具的表面清洗、消毒方式(例如:手工清潔、自動在線清潔等)及清潔驗證原則。
4.3????計算機化系統情況
簡述與藥品生產質量相關的關鍵計算機化系統情況。
5文件
5.1 ???描述企業的文件系統。
5.2 ???簡要描述文件的起草、修訂、批準、發放、控制和存檔系統。
5.3 ???如文件和記錄在生產場地外保存,應當提供外存的文件/記錄目錄、儲存場所的名稱和地址以及取回文件所需的時間。
6生產
6.1????產品情況
6.1.1 ??????生產場地所生產藥品的清單,按生產車間/生產線填寫,并注明各品種首次生產及生產場地變更情況(與附件1、附件2結合填寫)。品種范圍包括已獲得批準文號的品種、受托生產品種、僅供出口品種、在研藥品品種。包括高毒性、高致敏性、高活性物料操作的品種,應當在清單中予以標注,并標明產品專用設備設施或分階段生產情況(如有)。
6.1.2 ??????說明是否應用過程分析技術(PAT),并概述相關技術和計算機化系統應用情況(如有)。
6.2????工藝驗證
6.2.1 ??????簡要描述工藝驗證的原則及總體情況。
6.2.2 ??????簡述返工、重新加工等特殊情形的原則。
6.3????物料管理和倉儲
6.3.1 ??????原輔料、包裝材料、中間產品與成品的管理,包括取樣、待驗、放行與貯存。
6.3.2 ??????不合格物料和產品的處理。
6.4????產品追溯方式
簡要描述實現產品全過程追溯的方式。
7質量控制
描述企業質量控制實驗室中理化檢驗、微生物及生物學檢驗等質量控制活動。
8發運、投訴與召回
8.1????發運
8.1.1 ??????產品發運方式及客戶類別(醫院、藥品批發企業或由MAH銷售)。
8.1.2 ??????描述用來確認收貨單位資質是否符合要求的程序。
8.1.3 ??????簡要描述確保產品在運輸過程中符合其貯存條件要求的措施,例如:溫度/濕度控制。
8.1.4 ??????產品發運管理以及確保其可追溯的方法。
8.2????投訴與召回
簡要描述投訴處理系統、發運后問題產品處理程序、產品召回系統。
9自檢
簡要描述企業自檢程序,重點說明自檢計劃中涉及范圍的選擇標準、自檢實施以及整改要求。
10.修訂歷史
藥品生產場地管理文件應當根據場地信息變化情況及時更新,并建立文件修訂歷史,修訂歷史內容應當至少包括文件編號及版本、生效日期及全部修訂內容的概述。
附件1?生產場地藥品品種清單? 附件2?生產場地高毒性、高致敏性、高活性品種清單 附件3 生產場地生產車間/生產線清單 附件4?生產場地接受現場檢查情況清單 附件5 生產場地藥品抽驗情況清單? 附件6?生產場地建筑物清單 附件7 生產場地關鍵設備清單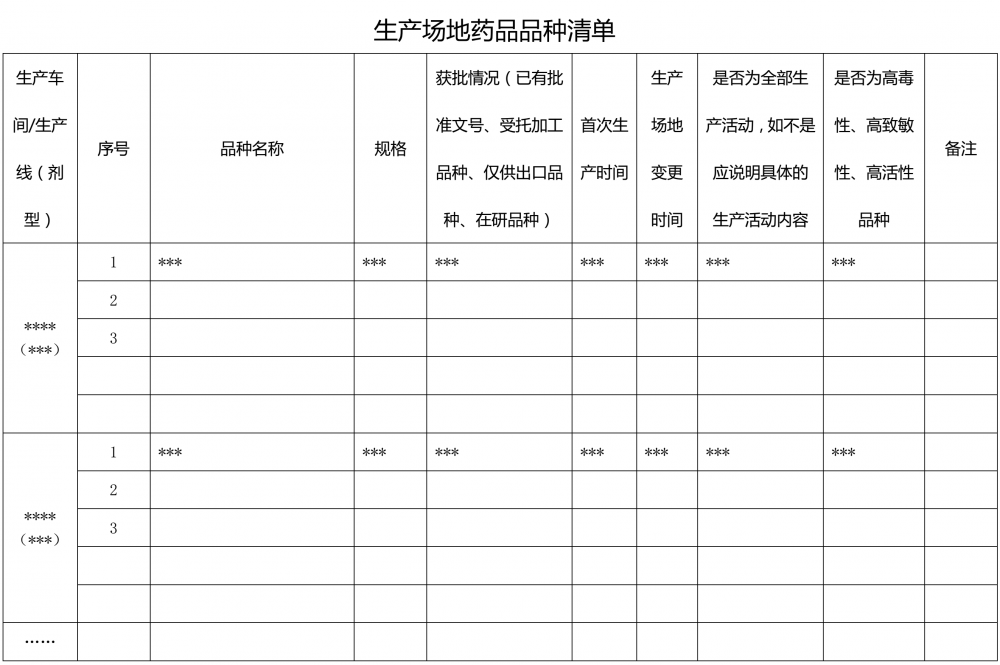
上一篇: 科冠醫藥項目合作信息
下一篇: 干貨 | 日本注射劑滅菌工藝選擇思路簡介







